

《大学有机化学《第十章 醇和酚》PPT课件》是由用户上传到老师板报网,本为文库资料,大小为3.35 MB,总共有59页,格式为ppt。授权方式为VIP用户下载,成为老师板报网VIP用户马上下载此课件。文件完整,下载后可编辑修改。
- 文库资料
- 59页
- 3.35 MB
- VIP模板
- ppt
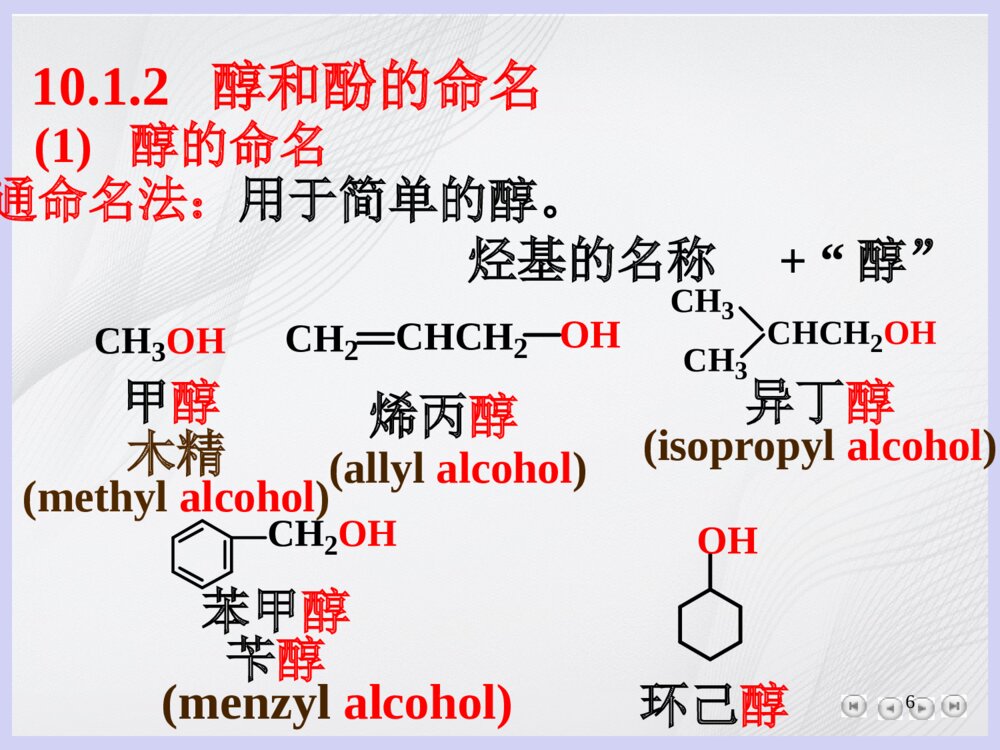
- 数字产品不支持退货
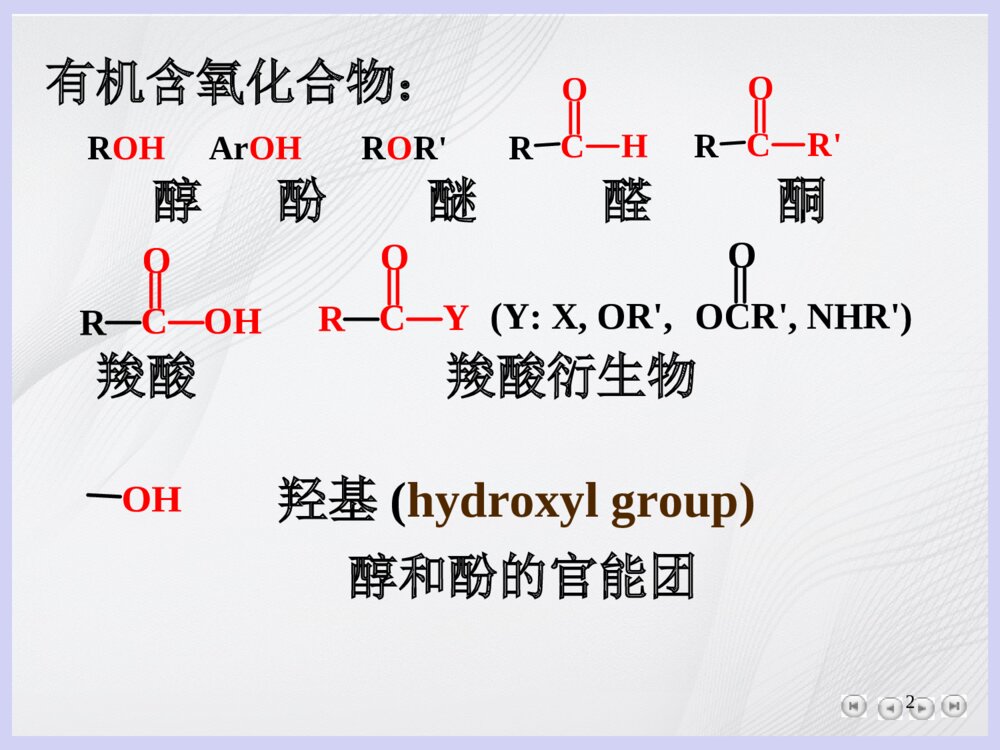
1第十章醇和酚10.1醇和酚的分类与命名10.2醇和酚的结构10.3醇和酚的物理性质10.4醇和酚的化学性质—醇和酚的共性10.5醇羟基的反应—醇的个性10.6酚芳环上的反应—酚的个性10.7醇和酚的制法2OH羟基(hydroxylgroup)醇和酚的官能团有机含氧化合物:羧酸羧酸衍生物醇酚醚醛酮ROHArOHROR\'RCOHRCOR\'RCOOHRCYO(Y:X,OR\',OCR\',NHR\')O3OHC醇(alcohols)羟基直接与饱和碳原子——sp3杂化碳原子连接。羟基直接与芳环上的碳原子连接。ArOH酚(phenols)CH3COHCH3CH3OHCH2OH叔丁醇苄醇环己醇OHCH3OHOH苯酚对甲苯酚α–萘酚410.1醇和酚的分类与命名10.1.1醇和酚的分类醇:(a)按分子中所含羟基的数目CH3CH2OHCH2CH2OHOHCH2CHOHOHCH2OH乙醇乙二醇丙三醇一元醇二元醇三元醇(b)按与羟基相连的烃基醇脂肪醇芳香醇不饱和醇饱和醇CH3CH2CH2CH2OH丁醇CH2CHCH2OH烯丙醇HCCCH2OH2–丙炔醇CH2CH2OH2–苯基乙醇5(c)按与羟基相连的碳原子的种类CH3CH2CH2OHCH3CHCH3OHCH3CCH3CH3OH伯醇仲醇叔醇酚:分子中所含羟基的数目苯酚对苯二酚间苯三酚一元酚二元酚三元酚OHOHOHOHHOOH610.1.2醇和酚的命名(1)醇的命名(a)普通命名法:用于简单的醇。烃基的名称+“醇”CHCH2OHCH3CH3CH2CHCH2OHCH3OH异丁醇(isopropylalcohol)甲醇木精(methylalcohol)烯丙醇(allylalcohol)CH2OH苯甲醇苄醇(menzylalcohol)OH环己醇7(b)系统命名法•选择含有羟基的最长的碳链作为主链•从靠近羟基的一端编号•按主链碳原子数称“某醇”,并在名称前标明羟基的位次CH3CHCHCH3OHCH3CH3CHCH2CH2CHCH2CH3OHOH3–甲基–2–丁醇2,5–庚二醇(3-methyl-2-butanol)(2,5-heptanediol)8(2)酚的命名芳环名称+“酚”OHCH34–甲基苯酚甲酚OHOH邻苯二酚(儿茶酚)OHOH间苯二酚OHOH对苯二酚OHOHHO均苯三酚CH3CH2CH2CHCH2CH2CH2OHCHCH24–丙基–5–己烯–1–醇CH3OH4–甲基–1–环己醇CH2OHCHCH3OH环己甲醇1–苯(基)乙醇910.2醇和酚的结构HCOHH甲醇的结构:HCsp3杂化碳原子C-Oσ键COHHHH108.5°0.143nmsp2杂化碳原子p,π–共轭OH109°0.142nm苯酚的结构:图10.1甲醇和苯酚的结构示意图未共用电子对1010.3醇和酚的物理性质C4以下流动液体;C5~C11油状液体;C12以上蜡状固体;多数酚为无色液体。醇能形成分子间氢键:ORHHORHOR酚也能形成分子间氢键。沸点:低级醇的沸点比相对分子质量相近的烷烃高得多bp()℃甲醇65乙烷–88.611[补充]什么叫氢键?形成氢键的条件?XHY(静电引力)(分子间和分子内均可形成)X、Y:通常是F、O、N,电负性很大、体积较小、而且具有未共用电子对的原子.氢键不属于化学键,但它有方向性和饱和性.氢键比化学键弱,比范德华力强.氢键对分子的物理和化学性质有明显的影响.氢键的形成也影响着醇和酚在水中的溶解度。12COHHCH亲核取代反应弱酸性弱碱性质子化HACOHHHNu:CO氧化反应CC消除反应OHH10.4醇和酚的化学性质—醇和酚的共性醇的反应部位:13酸性芳环上的亲电反应芳醚的形成酚的反应部位:醇与酚化学反应的共性:10.4.1弱酸性ROOHH+HROH+OHH共轭酸共轭碱醇烷氧负离子水合离子OH+OHHYO+YH3O+酚酚氧负离子表9.1一些弱酸的pKa值酸pKaCH3OH15.5H2O15.74CH3CH2OH15.9(CH3)3COH18.0HCCH25H235NH338CH3CH350C6H5OH9.89相对酸性:ArOH>ROH>RCCH>H2>NH3>RH相对碱性:R->NH2->H->RCC->RO->HO->ArO-162CH3CH2OH+2Na2CH3CH2ONa+H2CH3CCH3CH3OH+22KCH3CCH3CH3OK+H22NaH,NaNH2,NaOH,KOH酚的酸性OHOHpKa=18pKa=9.89CH3COOHpKa=4.74表9.2取代酚的酸性常数取代基pKa(25)℃邻间对―H―CH3―Cl―NO2―OCH310.2010.1010.178.118.809.207.178.287.159.989.6510.219.899.899.89取代基pKa(25)℃2,4–二硝基2,4,6–三硝基(苦味酸)(picricacid)3.960.3817苯环上的取代基对酚酸性强弱的影响(1)电子效应的影响:吸电子基团使酸性增强,给电子基团使酸性减弱。(2)空间效应的影响:空阻减弱溶剂化作用(溶剂化作用有利于酚羟基的离解),从而使酸性减弱。NO2OH>>>NO2OHNO2OHO2NNO2OHpka7.157.228.394.09O2NNO2OHNO2CH2C(CH3)3CH2C(CH3)3(CH3)3CCH2OH0.25酸性极弱18OH+NaOHONa+H2O(I)H2CO3:pKa=6.38ONa+CO2+H2OOH+NaHCO3(II)分离、鉴别酚1910.4.2醚的生成通常使用醇和酚的金属盐与卤代烃或硫酸二甲(乙)酯作用,生成相应的醚:(CH3)2CHONa+CH2Cl84%(CH3)2CHOCH2异丙醇钠苄氯异丙基苄基醚酚与卤代烃或硫酸酯在碱的作用下生成芳醚:ArOHNaOHArONaRXArOR+NaX(X=Cl,Br,I,OSO2OR\')反应先生成芳氧负离子,随之发生SN2反应20(CH3)2SO4是一个常用的甲基化试剂。OH+NaOHH2OONaCH3OSO2OCH3OCH3+NaOSO2OCH3茴香醚10.4.3酯的生成醇羧酸酸催化下缩合反应酯水可逆反应ROH+R\'COOHH2SO4R\'COOR+H2O21CH3OH+COOHH2SO4¡÷COOCH3+H2O甲醇(0.6mol)苯甲酸(0.1mol)甲基苯甲酸酯(70%)加入苯,蒸出水和苯的共沸物,除去水,使平衡向右移动。N醇还可以与其它酰基化试剂发生酯化反应:ROH+R\'COCR\'OOR\'CORO酰氯酸酐ROH+R\'CClOR\'CORO22碱的作用下,醇与磺酰氯反应生成磺酸酯:对甲苯磺酰氯TsCl对甲苯磺酸乙酯TsO―CH2CH3CH3SOOCl+CH3CH2OH吡啶HClCH3SOOOCH2CH3TsO―是弱碱,很好的离去基团,磺酸酯亲核取代反应Nu+ROTsSN2NuR+OTs23FCH2CH2CH2OHK2Cr2O7H2SO4,H2OFCH2CH2COHO3–氟–1–丙醇3–氟丙酸(74%)CH3CH2CH2CH2OHK2Cr2O7,稀H2SO4,50%CH3CH2CH2CHObp117.7Cbp75.7C为了避免醛进一步被氧化,需将产物蒸出:限于制备bp<100℃的醛10.4.4氧化反应(1)一元醇的氧化伯醇醛进一步氧化羧酸ROH[O]RCOH[O]RCOOH24(C2H5)2CCH3CH2OH+PCCCH2Cl225CCH3(C2H5)2COCHPCC试剂不氧化C=C键CH2OHPCCCH2Cl2COH香茅醇香茅醛(82%)RCH2OHPCCCHORPCC试剂溶于CH2Cl2CrO3+HCl+NNHCrO3Cl氯铬酸吡啶盐(pyridiniumchlorochromate)(PCC)a.使用PCC试剂可将反应控制在生成醛的一步:25b.活性MnO2该氧化剂对活泼的烯丙位醇具有很好的选择性氧化作用,而不影响C=C双键。CH3CHCHCHCHCCHCH2OH===CH3MnO2CH2Cl2CH3CHCHCHCHCCHCHO===CH3c.DCC-DMSODCC:¶þ»·¼º»ù̼¶þÑÇ°·N=C=N(Dicyclohexylcarbodimide)(Dimethylsulfoxide)DMSOHODCC-DMSOH3PO4£¨ÉÙÁ¿£©O26RCHR\'OHK2Cr2O7H2SO4,H2ORCR\'O仲醇[O]酮仲醇的氧化:H2CrO4铬酸OHNa2Cr2O7H2SO4,H2OO环己醇环己酮(85%)COHRR\'R\"[O]不反应叔醇无α–氢,一般条件下不被氧化27(2)一元醇的脱氢伯醇或仲醇高温时,在金属的催化作用下发生脱氢反应,生成醛或酮:CH3CH2OHCu~300℃CH3CHO金属:Cu,Ag,Ni等(3)α–二醇的氧化α–二醇与HIO4作用,C―C键断裂,生成羰基化合物:RCHOHR\'CHOH+OIOOOHRCHR\'CHOOIOHOHOHO28加入AgNO3,可用于α–二醇的鉴定。AgIO3-H2ORCHOR\'CHO+HIO3(4)酚的氧化OHOHK2Cr2O7H2SO4,H2OOO对苯二醌(氢醌)对苯醌酚在氧化剂的作用下生成醌:29OH蓝紫色OHOH绿色CH3OH蓝色10.4.5与三氯化铁显色反应6C6H5OH+FeCl3[Fe(OC6H5)6]3-+6H++3Cl-酚、烯醇FeCl33010.5醇羟基的反应—醇的个性10.5.1弱碱性盐的生成:醇与强酸作用,羟基质子化CH3CH2OH+H2SO4CH3CH2OHHHSO4盐C2H5OH:pKb=16醇既是酸,又是碱:ROHROH2Ç¿ËáÇ¿¼îRO利用醇的弱碱性,使―OH质子化:很不好的离去基团―OH好的离去基团H2O31反应相对活性:HI>HBr>HClHX:ROH:RCHCHCH2CH2,>3°>2°>1°>CH310.5.2与氢卤酸反应ROH+HXX+H2OR醇与氢卤酸反应,C―O键断裂,C―X键生成:(CH3)3COH+HCl室温(CH3)3CCl+H2OCH3(CH2)3CH2Cl+HClZnCl2回流4hCH3(CH2)3CH2OH+H2OOH+HBr回流6h74%Br+H2O32烯丙型醇、苄醇、叔醇、仲醇按SN1机理反应。反应机理SN1反应机理:第一步:H3CCCH3OHCH3+H快H3CCCH3OCH3HH第二步:H3CCCH3OCH3HH慢H3CCCH3CH3+H2O第三步:H3CCCH3CH3+Cl快H3CCCH3CH3Cl33+HCCH3CH3CHOH2CH3H+OHCCH3CH3CHHCH3+H2OCHCH3CCH3CH3H2oÕý̼Àë×ÓCH3CH3CH3CHCHBrBrÖØÅÅCH3CCH3CHHCH3+CH3CH3CCH2CH3BrBr3oÕý̼Àë×Ó仲醇与HX酸的反应中,生成重排产物则是SN1机理的重要特征。SN2机理:(多数1o醇特点:没有重排)34但,新戊醇这一伯醇与HCl的作用却是按SN1历程进行的,且几乎都是重排产物。CH3CCH2CH3CH3OHH+CH3CCH2CH3CH3CH3CCH2CH3CH3+ÖØÅÅCH3CCH2CH3CH3+1¡ã̼ÕýÀë×ÓOH2+H2O3¡ã̼ÕýÀë×ÓClCH3CCH2CH3CH3Cl解释:若按SN2历程进行,空间位阻较大,亲核试剂难从背后进攻中心碳原子。35醇的亲核取代反应比卤代烷困难,其原因在于醇羟基的碱性较强,是个不好的离去基团。碱性:HO->X-实验表明:强酸的负离子(如下)是较好的离区基团:CH3SO2O¡¢XHO¡¢RO¡¢NH2负离子是不好的离去基团。因此,醇的亲核取代反应需在酸催化下进行,或将醇羟基先转化为好的离去基团,以利于反应的进行。36Lucas试剂:浓HCl—无水ZnCl23o´¼¡¢Ï©±û´¼¡¢Üд¼ÊÒÎÂÏ·´Ó¦ÒºÁ¢¼´»ì×Ç¡¢·Ö²ã£»2o´¼2~5min.·´Ó¦Òº»ì×Ç¡¢·Ö²ã£»1o´¼¼ÓÈÈ£¬·´Ó¦Òº»ì×Ç¡¢·Ö²ã£»10.5.3与卤化磷的反应醇与PX3、PX5反应生成RX:RCH2OH+BrPBrBrRCH2OHPBrBrBrSN2RCH2X+HOPBr237RCH2OH+ClSClOHClRCH2OSOClOSOClRCH2+RCH2Cl+SO2离子对SN1反应10.5.4与亚硫酰氯的反应说明:(i)醇与PX3作用生成卤代烃的,通常按SN2历程进行。(ii)一般不发生重排。(无碳正离子中间体)(iii)反应的立体化学特征:构型反转。缺点:若对生成的酸性气体处理不利会造成环境污染;只适合制备氯代烷。3810.5.5脱水反应(1)分子间脱水2CH3CH2CH2CH2OHH+¡÷CH3CH2CH2CH2OCH2CH2CH2CH3+H2O两分子醇在酸催化下,分子间脱水,生成醚HOCH2CH2CH2CH2CH2OHH2SO4¡÷O+H2O(1,5–戊二醇)(烷)(76%)催化剂:质子酸:H2SO4,H3PO4等Lewis酸:Al2O3硅胶、多聚磷酸、KHSO439反应特点:•此反应仅适于伯醇•SN2反应•用于单醚的制备反应机理:第一步:羟基质子化CH3CH2OH+H+OHHCH3CH2第二步:另一分子醇作为亲核试剂进攻中心C原子CH3CH2OH+OHHCH3CH2SN2CH3CH2OCH2CH3H+H2O此步骤是决定反应速率的一步40第三步:失去质子,生成醚CH3CH2OCH2CH3HCH3CH2OCH2CH3+H+(2)分子内脱水2CH3CH2OHH2SO4180℃H2SO4140℃2CH2CH2+H2OCH3CH2OCH2CH3+H2O醇的分子内脱水与其分子间脱水是竞争反应:叔醇主要得到消除产物烯烃,伯醇主要得到取代产物醚;高温有利于生成烯烃,低温生成醚。41浓H2SO4,170C或Al2O3,360¡æCH2CH3CH2OHCH2+H2OCCH3CH3CCH3OHOHCH3Al2O3¡÷£¬80£¥H2CCCH3CCH3CH2+2H2O酸的加入,改变离去基团的性质,OHOH2+反应特点:•在质子酸催化下,反应按E1机理进行:CCHOH+H+快CCHOH2在质子酸作用下,各类醇均按E1机理进行反应。CCHOH2H2OCCHCC+H+42•-H消除方向符合Saytzeff规则:CH3CHCHCH3HOH62%H2SO487℃,80%CH3CHCHCH3+H2O•反应活性:烯丙型>叔醇>仲醇>伯醇CH3CH2CH2CH2OH75%H2SO4140℃CH3CH2CH2CHCH2H3CCCH3OHCH320%H2SO4~85℃H3CCCH3CH2E1历程,中间体为碳正离子,可能先发生重排,然后再按Saytzeff规则脱去一个β-H而生成烯烃。如:43CH3CCHCH3CH3CH3OHH+CH3CCHCH3CH3CH3OH2+CH3CCHCH3CH3CH3H2O+ÖØÅÅCH3CCHCH3CH3CH3+H+CCCH3CH3CH3CH3CH2CCHCH3CH3CH3=+(20%)(80%)Saytzeff²úÎï•用Al2O3代替质子酸时,碳骨架不会发生重排。H3CCCH3CH3CHOHCH3气相,△Al2O3H3CCCH3CH3CHCH24445频哪醇重排:CCH3CH3CCH3OHOHCH32,3–二甲基–2,3–丁二醇(频哪醇)3,3–二甲基(–2–)丁酮H+CCH3CH3COCH3CH3重排反应机理:CCH3CH3CCH3OHOHCH3H+CCH3CH3CCH3H2OOHCH3H2OCCH3CH3CCH3OHCH3CCH3CH3COHCH3CH3重排CCH3CH3COHCH3CH3H+CCH3CH3COCH3CH346不对称的邻二醇,重排如何进行?优先生成较稳定的碳正离子决定基团迁移及反应的产物。CCCH3HOOHCH3H+-H2OCCCH3CH3OH+ÖØÅÅ-H+CCCH3H3CO提供较多电子的基团优先迁移CCHOOHCH3H+-H2O+H3CCCCH3H3COHÖØÅÅ-H+OCH3CH3CC迁移能力:芳基>烷基或H47强酸溶液邻对位二溴代物低温低极性或非极性溶剂一溴代物OH+Br25℃CS2OH+HBrBr10.6.1卤化OH+3Br2H2OOH+3HBrBrBrBr(白)亲电取代反应羟基邻对位定位基用于苯酚的定量定性的鉴定(100%)10.6酚芳环上的反应——酚的个性48OH(浓)H2SO425¡æ100¡æOHSO3HSO3HOH100¡æ10.6.2磺化动力学控制产物热力学控制产物控制反应速率控制反应温度10.6.3硝化OH20%HNO325¡æOHNO2+OHNO2(30%~40%)(20%)NOOHO分子内氢键:HONOOHONOO分子间氢键:49反应特点:•需稀硝酸,浓硝酸使芳环氧化•用水蒸气蒸馏,将邻取代产物分离10.6.4Friedel–Crafts反应Friedel–Crafts烷基化反应以对位产物为主OH+(CH3)3CClHFOHC(CH3)3+HCl当对位有取代基时,烷基进入邻位:OHCH3+2(CH3)2CCH2H2SO4或酸性氧离子交换树脂OHCH3(CH3)3CC(CH3)34–甲基–2,6–二叔丁基苯酚5010.6.5与甲醛缩合——酚醛树脂及杯芳烃(1)酚醛树脂苯酚与甲醛作用,在邻/对位上引入–CH2OH,其产物与酚发生烷基化反应:OHHCHO催化剂OHCH2OHOHOHH2OCH2OHHOCH2OHOHH2O»òHOCH2OHOHCH2OH51苯酚与过量的甲醛在碱性介质中,产生热固性酚醛树脂:OHCH2OHCH2CH2CH2CH2OHCH2CH2CH2HOCH2CH2CH2HO52(2)杯芳烃(calixarenes)苯酚类似物与醛缩合可生成环状寡聚物:OHC(CH3)34+4HCHONaOH,260℃>60%(CH3)3COHC(CH3)3OHC(CH3)3OHHOC(CH3)3+4H2O对叔丁基杯[4]芳烃53一、醇的制备1、卤代烷水解2、以烯烃为原料a.烯烃的水合b.烯烃的硼氢化氧化CHRCH2CHRCH3OHH2O/HCHRCH2CH2RCH2OHBH3H2O2/OH10.7醇和酚的制法543、格氏试剂与羰基化合物等反应RMgX+C=OÎÞË®ÒÒÃÑR-C-OH+MgOHXR-C-OMgXH+H2Oa.RMgX+H-C-HOÎÞË®ÒÒÃÑR-C-OMgXHHH2OH+RCH2OH(1)ÖÆ1o´¼MgCl+HCHOÎÞË®ÒÒÃÑH2OH+CH2OH在格氏试剂烃基上增加一个碳原子(格氏试剂与甲醛反应)CH3CH2CH2MgBr+1)ÎÞË®Et2O2)H3O+CH3CH2CH2CH2CH2OHb.O在格氏试剂烃基上一次增加两个碳原子55(2)制2°醇(格氏试剂与醛反应)a.RMgX+R\'-C-HOÎÞË®ÒÒÃÑR-CH-OMgXH2OH+RCHOHR\'R\'CH2MgCl+CH3CHOÎÞË®ÒÒÃÑH2OH+CH2CHOHCH3b.一取代环氧乙烷与格氏试剂反应MgBr+CH3CHCH2OEt2OCH2CHCH3OMgBrH+H2OCH2CHCH3OH在格氏试剂烃基上一次增加两个以上碳原子。56C-CH3O+CH3CH2MgBr1)Et2O2)H3O+C-CH2CH3CH3OH(3)制3o醇格氏试剂与酮反应ORCH2MgBrHOCH2R57二、酚的制备二、酚的制备11、从异丙苯制备、从异丙苯制备 工业上生产苯酚的主要方法 工业上生产苯酚的主要方法+CH3CH=CH2CH3CH(CH3)2AlCl385~95℃℃O2(空气),110~120℃℃过氧化物COOHCH3H稀2SO475~85℃℃OHCH3CCH3O+优点 原料价廉易得;生产优点 原料价廉易得;生产11吨苯酚的同时可得吨苯酚的同时可得0.60.6吨丙酮。吨丙酮。PhCCH3CH3OOHH+CCH3PhOOH2H3C+H2O_CCH3OPhH3C++CCH3OPhH3CH2O5822、从芳磺酸制备、从芳磺酸制备SO3NaONaOHNaOH,300~320℃℃共熔H3O+最早合成苯酚,设备简单,产率高,产品纯度高。最早合成苯酚,设备简单,产率高,产品纯度高。成本高,消耗大量酸、碱。现用于其它酚的合成。成本高,消耗大量酸、碱。现用于其它酚的合成。CCH3OPhH3COH2++CCH3OPhH3COHH+PhOHCH3CCH3OH+CH3CCH3O+H+59H2SO460oC120oCSO3HSO3HNaOHH+OHNaOHH+OH33、从芳卤衍生物制备、从芳卤衍生物制备取代苯酚取代苯酚::Cl+NaOHCu300oC28MPaONaH+OH氯苯难进行,有强吸电子基团时易进行亲核取代反应氯苯难进行,有强吸电子基团时易进行亲核取代反应



















